空军军医大学西京医院副教授胡兴斌团队与华东理工大学教授刘琴团队合作,首次揭示了血影蛋白依赖性死亡的新机制,即激活补充系统,触发血细胞程序性死亡(spectosis),它为溶血性疾病和炎症性疾病的治疗提供了一个新的药物靶点,不仅有助于人类疾病的治疗,而且可以在未来扩展到畜禽和水产养殖的传染病预防和控制领域。4月18日,相关研究在细胞中发表。
血细胞作为人体氧气运输的核心媒介,负责将血液中的氧气输送到各个器官,同时参与免疫控制。正常体内血细胞的平均寿命为120天,但在病理状态下,免疫系统可能会错误识别血细胞,“认识朋友为敌”,发动攻击,激活重要的免疫防御机制,如补体系统。由此产生的膜攻击复合物会在血细胞表面“钻孔”,从而破坏细胞的完整性,最终导致溶血。针对溶血性疾病,提高临床疗效是分析补体攻击引起的血细胞内部分子事件,发展目的性干预策略。
研究小组发现,在构建身体激活诱导溶血的体外模型的基础上,身体信号的激活将导致红细胞的程序化形态依次重塑,并伴随着细胞内容物排放的变化。进一步实验证实,身体激活可以触发血细胞中的迷你NLRP3-ASC-caspase-8信号通路级联反应,进而引导下游核心功能靶点血影蛋白β亚基(β-spectrin)酶切裂,膜骨架随着解体而溶血。因此,研究小组将这种新的程序性死亡方式命名为“spectosis”。
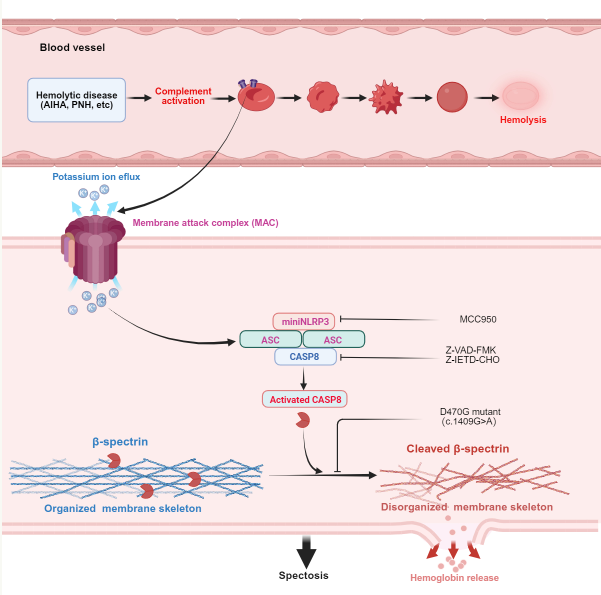
在此基础上,研究小组进行了一系列内部和外部试验进行验证。在临床试验中,研究小组建立了急性溶血性输血反应的小鼠模型,成功再现了补充依赖性溶血的过程,并从遗传学的角度解释了spectosis的关键机制。此外,研究小组选择了补充信号C3抑制剂和NLRP3炎症小体抑制剂进行干预,发现两种药物联合使用“协同效应”,显示出“1” 1>2"治疗效果,显示了spectosis通道关键目标的治疗价值。
据刘琴介绍,该研究系统阐明了spectosis信号通路的分子机制,并创新地提出了“补体抑制”。“细胞死亡障碍”的联合治疗有望突破补充系统激活的瓶颈,为溶血性疾病的治疗开辟重要途径。目前,研究团队已开始建立以血细胞spectosis为核心的药物筛选平台。第一批筛选的药物分子在鱼类感染性肠炎的口服治疗中表现良好。
赞一个
更有众多热门








